什么是质子?质子中子电子关系解析
什么是质子?质子(Proton)是一种基本粒子,是构成原子核的组成部分之一,带有正电荷。质子的符号通常用字母 "p+" 表示,质子的电荷量等于电子的电荷量的相反数,即质子带有正电荷(+1),而电子带有负电荷(-1)。质子的质量约为1.67×10^-27 千克,是电子质量的约1836倍。
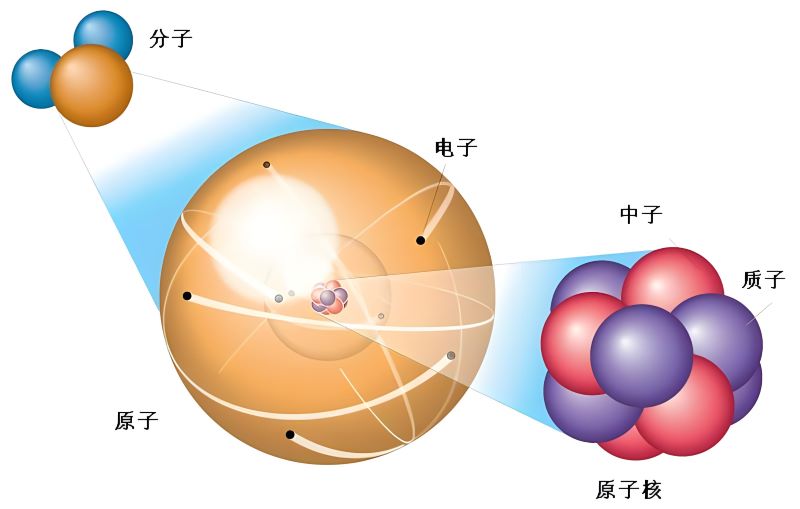
在常见的元素中,原子的质子数决定了元素的化学性质和元素的标识,即元素的原子序数(也称为质子数)。例如,氢原子(H)只包含一个质子,因此其原子序数为1;氦原子(He)包含两个质子,其原子序数为2;碳原子(C)包含六个质子,其原子序数为6,依此类推。
质子中子电子关系解析
质子、中子和电子是构成原子的三种基本粒子,它们在原子中起着不同的角色。
质子(Proton):质子是位于原子核内的基本粒子,带有正电荷(+1)。质子的数量决定了元素的原子序数,也是元素的标识。不同元素的原子核中质子的数量不同,从而决定了元素的化学性质和性质。质子间的相互斥力使得原子核中的质子趋于相互排斥,但通过核力的作用,质子和中子之间相互吸引,维持了原子核的稳定。
中子(Neutron):中子也位于原子核内,不带电荷,是一种中性粒子。中子的质量和质子相当,但在电荷上是中性的。中子在原子核中起到稳定原子核的作用,通过强相互作用与质子相互结合,维持了原子核的结构稳定性。
电子(Electron):电子是位于原子外部轨道(能级)上的负电荷粒子,带有负电荷(-1)。电子在原子中负责形成化学键和参与化学反应,决定了原子的化学性质和化学行为。电子和质子数量相等,使得原子保持电中性。
综上所述,质子和中子位于原子核内,起到维持原子核的稳定作用,而电子位于原子外部轨道,参与化学反应和形成化学键。质子、中子和电子的相互作用和数量决定了原子的性质和行为,从而决定了不同元素的特性。